Редакционная коллегия серии «Медицина и право»
Т. Б. Дмитриева (отв. ред.), Г. И. Заславский (отв. ред.), Г. О. Багатурия, О. В. Леонтьев, И. Е. Лобан, Е. В. Макушкин, Н. Г. Незнанов, В. В. Петров, В. Л. Попов, Н. П. Попова, В. А. Тихоненко, А. А. Ткаченко, В. Б. Шостакович, А. А. Эксархопуло
Рецензенты:
А. Н. Петров, доктор медицинских наук, профессор, директор НИИ токсикологии Минздравсоцразвития РФ
И. Н. Иванов, профессор, заведующий кафедрой судебной медицины Санкт-Петербургской медицинской академии последипломного образования
Авторы:
докт. мед. наук, проф., академик РАМН А. Я. Гриненко; докт. мед. наук, проф. В. В. Афанасьев; докт. мед. наук, проф. Р. В. Бабаханян; канд. биол. наук, доц. Е. С. Бушуев; канд. мед. наук, доц. В. В. Дунаевский; докт. мед. наук, проф., заслуженный врач РФ, член-корр. РАЕН Г. И. Заславский; докт. мед. наук, проф., заслуженный деятель науки РФ В. Л. Попов; канд. мед. наук А. Е. Сафрай; канд. мед. наук, доц. В. Д. Стяжкин Хроническая алкогольная интоксикация. – СПб.: Издательство Р. Асланова «Юридический центр Пресс», 2007. – 539 с.
СПИСОК СОКРАЩЕНИЙ
Введение
Смерть от острого или хронического отравления этиловым алкоголем – серьезная проблема для многих стран. На снижение смертности от этой патологии направляются усилия не только, а подчас и не столько сферы здравоохранения, сколько социально-экономических институтов общества.
В России хронологическая динамика употребления алкоголя носит весьма неполный характер и в некоторой части связана с известными социальными новациями и преобразованиями. Так, в 1985 году была начата антиалкогольная кампания, результатом которой стало резкое падение продажи и употребления алкогольных напитков. Уменьшились и показатели смертности, оставаясь на относительно низком уровне вплоть до 1992 года. Последовавшие затем политические и социально-экономические потрясения, либерализация экономики, снятие запретов на всякого рода социальные, общественные и морально-этические табу привели к постепенному, но достаточно устойчивому росту употребления алкоголя. При этом после спада показателей смертности в 1985 году предшествовавший «пик» был достигнут уже к 1993–1994 годам со стабилизацией и некоторым приростом показателей в начале XXI века.
Употребление алкоголя и рост смертности шли параллельными путями, причем более стремительными темпами, что, несомненно, должно быть связано с увеличением выпиваемой дозы, снижением качества алкогольной продукции, поступлением на рынок низкопробного «контрафакта» и суррогатов алкоголя. Смертность от интоксикации алкоголем увеличилась более чем в 2 раза по сравнению с 1984 годом[1].
«Опыт» прогрессивного наращивания продажи алкогольных напитков в современной России привел к увеличению смертности от острого отравления этиловым спиртом, формированию растущей армии людей с полиорганной недостаточностью, обусловленной систематическим употреблением алкогольных напитков.
Поначалу судебно-медицинские эксперты, сфера деятельности которых связана с такими наблюдениями, во многом оценивали их традиционно, как те или иные проявления острого отравления этиловым спиртом. Такой диагноз выставляли даже при несмертельных концентрациях этанола в крови умерших. При отсутствии же алкоголя в организме смерть человека с «алкогольным анамнезом» объясняли алкогольной кардиомиопатией, что приводило к искусственному и, следовательно, искаженному завышению смертности от заболеваний системы кровообращения. Между тем, как показывает ретроспективный анализ, именно в этих группах существенную долю занимают умершие от пагубного употребления алкоголя.
Все изложенное привело к необходимости углубленного изучения проблемы последствий алкоголизации населения. Дополнительным стимулом к такому изучению явились сравнительные данные о смертности от острого отравления и хронической интоксикации алкоголем в России и за рубежом. Если в России соотношение смертности от острого отравления и хронической интоксикации алкоголем составляет 8,5:1, то в странах Центральной и Западной Европы наблюдается обратное отношение 1:8,0–7,0, а в Южной Европе – 1:25. Такая разница никак не может быть объяснена только «национальной спецификой».
Смертность лиц, систематически употребляющих алкоголь и погибающих от недостаточности функции сердца, печени, почек, поджелудочной железы, нередко «растворяется» в статистике ненасильственной смерти, что искажает истинное положение вещей. В такой ситуации любые профилактические мероприятия по снижению смертности «слепы», лишены возможности выявления и предотвращения истинных причин и условий смерти и поэтому a priori не могут быть целенаправленными и эффективными.
Все изложенное побудило нас, представителей разных специальностей – судебно-медицинских экспертов, психиатров, наркологов, химиков-аналитиков, фармакологов, организаторов здравоохранения, – заняться этой темой для того, чтобы оказать своим коллегам помощь в клинико-морфологической диагностике, экспертной оценке и профилактике хронической алкогольной интоксикации на современном этапе развития российской медицины.
Эту книгу мы рассматриваем как первое приближение к затронутой проблеме и с благодарностью готовы прислушаться к любым комментариям и конструктивным советам.
Глава I
Патофизиологическая, биохимическая и клиническая характеристики хронической алкогольной интоксикации
Негативные эффекты этилового алкоголя обусловлены нарушениями обмена веществ в клетках различных органов, которые возникают вследствие постоянного повреждающего действия как самого яда и его метаболитов (ацетоальдегида, уксусной кислоты и алкогольных эфиров жирных кислот), так и продуктов других патологических продуктов, возникающих при действии этилового алкоголя (свободных радикалов, агрессивных молекул средней молекулярной массы и т. д.). Рассматривая злоупотребление алкоголем в прикладном аспекте, целесообразно выделить четыре компонента в повреждающем действии этих веществ:
– воздействие на внеклеточный матрикс,
– мембранный,
– лиганд-рецепторный,
– метаболический.
Подобное разделение позволяет раскрыть суть патохимических реакций, которые лежат в основе клинических проявлений хронической интоксикации этиловым алкоголем, а также объяснить новые подходы в их диагностике и лечении.
Взаимодействие с элементами внеклеточного матрикса
Всасываясь и распределяясь в организме человека, этиловый алкоголь изменяет биохимические процессы, протекающие в микроокружении клеток, в частности во внеклеточном матриксе (ВКМ). Компоненты последнего секретируются самими клетками и выполнены коллагенами, гликопротеинами и гелем, образованным водой и гидратированными в ней небольшими по размерам белковыми молекулами. В матриксе присутствуют биологически активные вещества, в том числе цитокины. Скопление биологически активных молекул в микроокружении клеток представляет собой организованную систему, которая играет роль биорегулятора, по крайней мере в пределах одногруппных кластеров клеток, и обеспечивает протекание биохимических реакций в клеточных мембранах и в самих клетках. Более того, передача биохимической информации через ВКМ имеет черты сходства с лиганд-рецепторным взаимодействием, подобным тому, которое происходит в синаптических и гормональных системах, только участники взаимодействия представлены элементами матрикса, плазматической мембраной и цитоскелетом клетки. Таким образом, образуется самостоятельная регуляторная система со своей структурно-функциональной единицей, которая наряду с другими системами организма осуществляет регуляцию его гомеостаза, в частности такие фундаментальные процессы, как деление клеток, их морфогенез, пролиферацию и т. д. (Ямсков И. А., 2001). Эта система является одной из первых мишеней для действия этилового алкоголя.
Подробности взаимодействия этанола с компонентами ВКМ мало изучены. Однако ясно то, что, по крайней мере, этиловый алкоголь может растворяться во внеклеточной воде, нарушать ее коллоидные и проводниковые свойства и приводить к изменению состава водных секторов. Молекулы этанола конкурируют с водой за связывание с различными составляющими ВКМ. В основе этой конкуренции лежит способность этанола и воды к образованию водородных связей, однако этанол является амфифильным соединением и, в отличие от воды, способен одновременно связываться с гидрофильными и гидрофобными центрами матрикса. Это приводит к вытеснению воды из внеклеточного сектора, к изменению конформационного строения молекул ВКМ и к нарушению состава супрамолекулярной организации и функции в целом. Известно также, что алкоголь нарушает активность матричных металлопротеиназ и ослабляет адгезию некоторых специфических субстратов ВКМ (Partridge, 1999).
Приведенные рассуждения имеют отношение к нескольким клиническим проблемам. Назовем две из них: особенности проведения инфузионной терапии при алкогольной патологии, а также получение и применение принципиально новых лекарственных веществ, выделенных из компонентов ВКМ, которые предназначены для лечения алкогольного абстинентного синдрома (ААС) и хронического алкоголизма в целом. Точкой приложения здесь являются гликопротеины ВКМ (например, нейролин, гепалон и др.).
Взаимодействие с липидами плазматических мембран Свободно проникая к самым различным клеткам, этанол оказывает действие на их плазматические мембраны. Он легко внедряется в их липидный бислой, связывается с конгломератами липидов мембран, «разделяет» жирнокислотные цепи фосфолипидов и увеличивает внутримембранные пространства бислоя. Одним из наиболее важных клинических последствий этого процесса является обезвоживание мембраны, которое происходит за счет вытеснения молекул воды (в среднем до двух из двадцати молекул), формирующих нормальную гидратную оболочку каждого из мембранных липидов (Ulrich et al., 1994). Подчеркнем, что в наибольшей степени вытесняются те молекулы воды, которые образуют важные водородные связи с карбоксильными группами соседних липидов и во многом определяют структурные, физико-химические свойства последних и биологических мембран в целом.
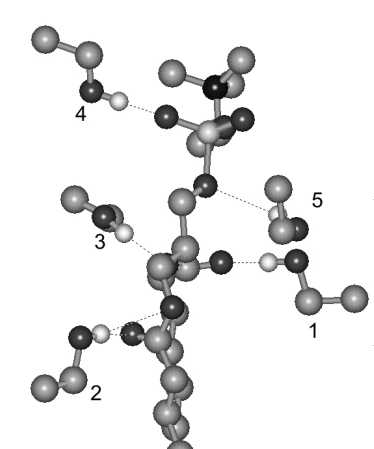
Рис. 1. Взаимодействие молекул этанола с фосфатидилхолином (молекулярное моделирование по П. П. Якуцени, 2002)
Условные обозначения: Показано типичное расположение фосфолипида и окружающих его пяти молекул этанола. Молекулы № 1, 2 и 3 образуют водородные связи (светло-серый цвет) с карбоксильными группами жирнокислотных остатков (темно-серый цвет). Отражены три из восьми возможных мест связывания этанола или воды. Молекулы этанола № 4, 5 образуют водородные связи с фосфатной частью полярной головки липидов (темный цвет). Отражены два из более чем десяти возможных мест связывания. Кислород выделен темным оттенком. Вертикальная (алкильная) цепочка липида (атомы водорода этой молекулы не показаны) уходит за нижнюю границу рисунка.
Известно, что мультислои фосфатидилхолина даже при нулевой относительной влажности содержат одну молекулу воды на один липид. При 15 % относительной влажности связываются две молекулы воды с липидом (Ивков В. Г., 1981), из них: 1,2 ± 0,3 молекулы воды взаимодействуют с фосфатной группой липида, а 0,7 ± 0,2 молекулы – с карбоксильными группами его жирнокислотных остатков. Считается, что межмолекулярные водородные связи образуются вторыми из указанных молекул воды. Выступая в роли своеобразных мостиков, они связывают карбоксильные группы соседних липидов.
При помощи молекулярного моделирования, отражающего взаимодействие одиночной молекулы фосфолипида (в данном случае – фосфатидилхолина) с молекулами этанола, П. П. Якуцени (2002) показал, что этанол также способен связываться с фосфатными группами фосфолипидов и карбоксильными группами жирнокислотных цепей (см. рис. 1). Расчеты, выполненные с помощью методов молекулярной фармакологии и квантовой механики, позволили предположить, что молекулы этанола способны вытеснять молекулы «связанной» воды из фосфолипидов биологических мембран и тем самым нарушать естественную структуру. Однако, в отличие от воды, этанол располагает только одной гидроксильной (OH) группой и не способен образовать мостика, связывающего молекулы соседних липидов друг с другом. Рабочая гипотеза П. П. Якуцени (2002) о механизме дегидратирующего действия этилового алкоголя, первично связанного со структурами липидного бислоя, подтверждена более поздними углубленными расчетами (см. рис. 2).
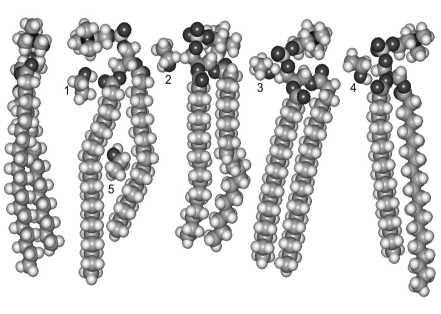
Рис. 2. Характерное распределение этанола в липидной мембране при концентрации алкоголя в плазме крови на уровне 1‰ (результат молекулярного моделирования П. П. Якуцени, 2002)
Условные обозначения:
Показана часть липидов верхней половины бислоя. Тяжелые атомы обозначены серым цветом, атомы водорода – светло-серым, кислород – темным цветом. Верхние молекулы этанола (№ 1–4) находятся в зоне преимущественного связывания, ниже которого расположен интерфазный слой мембран, содержащий протоноакцепторы. Нижняя молекула этанола (молекула № 5) вызывает дефект упорядоченности алкильных «хвостов» липидных молекул.
Оказалось, что образование водородных связей в наибольшей степени происходит на уровне интерфазного слоя липидной мембраны, в котором имеется большое количество функциональных групп – протоноакцепторов (эфирных и карбоксильных), способных фиксировать ионы водорода, т. е. там, где расположены функционально важные полярные головки фосфолипидов (см. верхнюю часть рис. 2). В мембранах непьющих людей между этими головками существует «пояс» межмолекулярных связей, образованный молекулами водорода и воды, который обеспечивает каркас липидных головок. Постоянное присутствие этанола в плазме крови на уровне 1‰, в первую очередь, разрушает этот молекулярный «пояс» и является центральным эффектом этанола, разупорядочивающего структуру липидной мембраны. Увеличение концентрации этанола в плазме крови до 2 % и более вытесняет оставшиеся молекулы связанной с липидами воды и изменяет их гидратную оболочку. Это приводит к нарушению композиции биологических мембран клеток. Длительная алкоголизация приводит к насыщению мембран спиртом и к изменению конформаций жирнокислотных цепочек липидов, что сопровождается структурными дефектами гидрофобной части мембран клеток.
Представленный процесс является элементом физико-химического механизма адаптации организма человека, возникающей при хронической интоксикации этиловым алкоголем.
В контексте рассматриваемой проблемы нарушение гидратной оболочки липидной части мембран клеток приводит к двум клиническим последствиям:
– сдвигу водных секторов между вне– и внутриклеточным пространством и развитию дисгидрии, порой жизнеопасной;
– изменению чувствительности рецепторов к лекарственным препаратам.
Специфику дегидратации при ААС необходимо учитывать при проведении инфузионной терапии, а изменение фармакодинамики лекарственных веществ – в проведении медикаментозной терапии таких больных.
В мембранах клеток рецепторы и ферментные комплексы фиксированы липидами, как якорями. Если белки не закреплены в мембране, то они «плавают» в ее липидном бислое, как льдинки в воде. В результате постоянного присутствия этанола некоторые из них «тонут» и становятся неспособными взаимодействовать со своими эндогенными лигандами (или лекарственными препаратами).
В мембранотоксическом действии этанола есть еще одна особенность, затрагивающая деятельность клеток всех типов. Липидный слой плазматических мембран представлен гликолипидами, холестерином и фосфолипидами. Последних – большинство, и они играют наиболее важную роль в обмене веществ в нейронах, глие, гепатоцитах, миокардиоцитах и других клетках. В состав фосфолипидов входят фосфатидилхолин (лецитин), фосфатидилэтаноламин, фосфатидилинозит, сфигномиелин и другие вещества, которые при ферментативном распаде образуют ряд важнейших биологически активных соединений или их предшественников. Например, из фосфатидилинозита образуются два вторичных посредника, инозитол-3-фосфат и диацилглицерин, необходимые для передачи медиаторных, гормональных и других информационных сигналов клеткам. Фосфатидилхолин (лецитин) служит предшественником синтеза холина, ацетилированная форма которого (ацетилхолин – медиатор) осуществляет нейротрансмиссию в нервной системе и защищает ее от избыточных адренергических воздействий. Это свойство лецитина интенсивно изучается с целью поиска способов фармакологической защиты печени, мозга и сердца от повреждений, возникающих при алкоголизации.
Удельный вес компонентов липидного бислоя в семействах различных клеток варьируется. Изменения, возникающие в них под действием этилового спирта, развиваются в соответствии с их биохимическим составом. Попадая в кровь, продукты деградации липидов могут индуцировать некоторые ферменты (например, усиливать активность фосфотидилэтаноламинметилтрансферазы) и служить источниками образования эндоперекисей, пагубная роль которых при алкогольной болезни в последние годы убедительно доказана.
Чем длительнее прием алкоголя, тем боульшие повреждения в мембранах он вызывает, вплоть до полного исчезновения определенных субстратов в некоторых из них. Например, сравнительный морфологический анализ липидного состава биомембран, проведенный на препаратах большого мозга и мозжечка неалкоголиков и алкоголиков, показал отсутствие у последних плазмалогенов в плазматических мембранах головного мозга (Leasch, 1972). (Плаз-малогены – липидные соединения, входящие в состав миелина глиальных клеток и обеспечивающие изолирующие свойства их отростков.) Возможно, поэтому проведение инфузионной терапии больным с абстинентным синдромом натрийсодержащими растворами может сопровождаться активацией демиелинирующих процессов в нервной ткани и приводить к инвалидизации таких больных (Illowsky et al., 1987).
В результате нарушаются матричная и транспортная функции мембран клеток, страдает трансмембранный перенос веществ в клетки и координация деятельности последних в целом.
Липиды мембран являются липофильными веществами, поэтому в водной среде они агрегируют за счет гидрофильных воздействий и Ван-дер-Ваальсовых сил. Жирорастворимость этанола резко снижается по мере его разбавления водой, вплоть до 50 % при 40 %-ной концентрации. Сопоставление этих двух факторов позволяет сделать вывод о том, что чем крепче спиртные напитки, тем большее мембраноповреждающее действие они оказывают. Особенно это касается напитков более крепких, чем водка.
Взаимодействие с рецепторами биологических мембран различных клеток
Помимо поражения плазматических мембран клеток, этиловый алкоголь оказывает действие на их рецепторы. Последние представлены интегральными белками, иногда очень сложными по своей структуре. Они регулируют прохождение ионов и биологически активных веществ через мембраны нейронов и клеток исполнительных органов (так называемые ионотропные рецепторы) и участвуют в обмене веществ в клетках, осуществляя эволюционно закрепленные каскадные биохимические реакции, которые начинаются в мембранах клеток (так называемые метаболотропные рецепторы). В организме человека рецепторы синтезируются, транспортируются к своим «местам узнавания» – в мембраны клеток и органелл. Этот процесс контролируется определенными генами, следовательно, плотность белков-рецепторов в пределах своих локусов закреплена наследственно и является различной у разных людей. С этим обстоятельством связывают предрасположенность людей к алкоголизму, поскольку определенные медиаторные системы головного мозга и их рецепторы участвуют в нейроадаптивном сдвиге, возникающем в организме человека при частом употреблении им спиртных напитков.
Действие алкоголя приводит к нейрохимическим изменениям в пределах локусов мозга с наибольшей плотностью тропных к нему рецепторов, таких как НМДА-, дофамин-, опиатергических, серотониновых и др. Однако последствия возбуждения рецепторов могут быть компенсированы еще пока не нарушенными метаболическими реакциями, протекающими в цитоплазме и ядрах клеток (например, глюконеогенез, гликолиз, синтез НАД, эвакуация ионов водорода, нейтрализация эндоперекисей и др.). Каждая группа рецепторов координирует определенные функции в организме человека. Постоянное возбуждение рецепторных систем может приводить к нарушению этих функций. Некоторые их них представлены на рисунке 3.
Продолжающаяся алкоголизация вызывает изменения, превышающие «систему надежности» организма, что влечет за собой развитие самых различных нарушений.
Изучение механизмов формирования алкогольной мотивации является одной из наиболее важных проблем в нейрохимии и нейробиологии алкоголизма, сложность решения которой заключается в разнообразии методических подходов для ее решения и трудностях в интерпретации психобиологических, психофизиологических и нейрохимических взаимосвязей, возникающих при такой патологии.
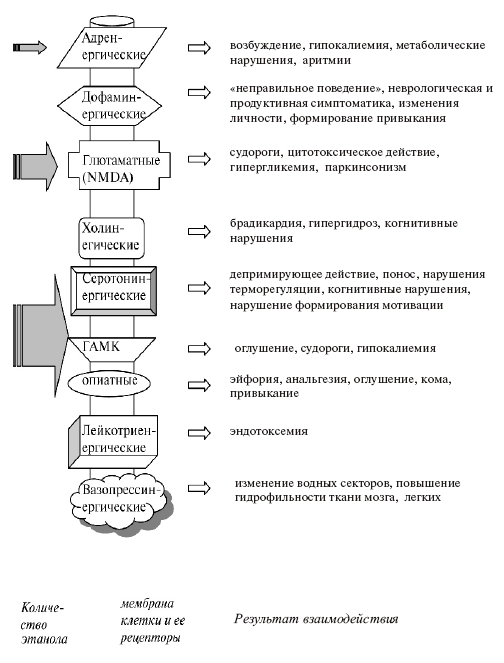
Рис. 3. Взаимодействие этанола с некоторыми рецепторами
Разнонаправленные исследования, выполненные в этой области знаний, указывают на то, что в формировании мотивации к употреблению алкоголя и появлении аддиктивного поведения, характеризующегося непреодолимой тягой человека к приему спиртного, главная роль принадлежит медиаторным системам головного мозга. Подчеркнем, что подавляющее большинство лекарственных веществ, применяемых в современной терапии алкоголизма, направлено на восстановление нейрогенной адаптации или нормоергии между многообразием возбуждающих и тормозных структур ЦНС.
В процессе развития зависимости от этанола в наибольшей степе ни изучена роль опиоидных, катехоламин-, серотонин-, ГАМК-, НМДАергических систем головного мозга человека. Уже на ранних стадиях ее формирования возникает разлад в сбалансированной работе возбуждающих и тормозных медиаторных систем. Возрастает активность НМДА-рецепторов в определенных структурах ЦНС (преимущественно в миндалине, гиппокампе, n. accumbens), увеличивается выход дофамина и норадреналина из соответствующих нейронов, а высвобождение ацетилхолина, серотонина и ГАМК в определенных участках мозга снижается.
Каждому из перечисленных медиаторов свойственно контролировать определенную совокупность процессов, протекающих в головном мозге и в периферических функциональных системах организма человека. Сбой равновесия на уровне нейрональных цепей изменяет взаимосвязи медиаторов с другими аутокоидами ЦНС, что влияет на состояние самого головного мозга и других систем организма, таких как сердечно-сосудистая, эндокринная, дыхательная и т. д.
Изменение активности медиаторных систем сопровождается нарушением динамики трансмембранных ионных потоков и кинетики биохимических реакций в клеточном окружении и в самих клетках (с изменением ионного состава которых связывают многие побочные эффекты лекарственных веществ, применяемых в период детоксикации). Некоторые ионы выполняют функцию коферментов в метаболических циклах. По вреждение рецепторов, как и повреждение мембран, вносит свой вклад в нарушение обмена веществ в клетках за счет сдвига ионного равновесия и изменения водных секторов во вне– и внутриклеточных пространствах. С нарушением ионного баланса связывают осложнения хронического алкоголизма и клинические состояния, возникающие при ААС, такие как судороги, дегидратация, демиелинирующие процессы в нейронах и др. Тяжелое течение ААС, осложняющееся делирием, также объясняют изменением транспорта ионов и аутокоидов через мембраны нейронов (Wettering et. al., 1994).
Продолжение приема спиртных напитков сопровождается стабилизацией дисбаланса центральных возбуждающих и тормозных нейротрансмиттерных систем, однако постепенно плотность НМДА-рецепторов и их чувствительность к глютамату-медиатору увеличиваются. Если в нормальном состоянии НМДА-рецепторы обеспечивают некоторые пластические процессы в нейронах головного мозга (Tabakoff, 1994), то при увеличении их количества и активности могут возникать нежелательные явления, такие как нарушения когнитивных функций вплоть до тяжелого их поражения. Порой могут иметь место такие жизнеопасные нарушения, как ишемия мозга и судороги.
Действие метаболитов этилового алкоголя
Выделенный метаболический аспект токсического действия этилового алкоголя связан с его биотрансформацией, продукты которой являются «четвертой силой», разрушающей клетки изнутри.
Этанол блокирует гексокиназную ферментную систему, которая обеспечивает проникновение глюкозы в клетки и переход ее в глюкозо-6-фосфат. Глюкозу потребляют клетки всех тканей, поэтому при ее недостатке возникает гипогликемия и создаются предпосылки для снижения интенсивности гликолиза и цикла Кребса. Головной мозг и эритроциты особенно чувствительны к гипогликемии, поэтому в организме человека существуют дополнительные источники получения глюкозы на случай чрезвычайной ситуации. Такими источниками являются депо гликогена в печени и ресинтез глюкозы из ее предшественников: аминокислот, лактата и глицерина, которые имеются в каждой группе клеток. Подчеркнем, что все же главным источником поступления глюкозы в организм является пища.
Метаболические последствия в виде гипогликемии, возникающей даже после умеренного однократного приема этилового спирта, частично компенсируются перечисленными биохимическими механизмами. Острая интоксикация этанолом вызывает «биохимическую бурю», а частое употребление спиртных напитков можно сравнить с постоянно действующей чрезвычайной ситуацией для промежуточного обмена веществ.
Во-первых, принятая с пищей глюкоза не усваивается из-за блокады гексокиназы, «да и есть не особенно хочется», поскольку 1 г этанола поставляет около 7 Ккал (для сравнения: это калораж, затрачиваемый на 150 м пути, если грести по воде сидя в лодке). Однако «алкогольные» калории не аккумулируются в макроэрги-ческих связях и дают только тепло.
Во-вторых, при биотрансформации этилового алкоголя в рассматриваемых условиях дополнительные источники получения глюкозы либо блокируются (как, например, глюконеогенез), либо истощаются (как, например, гликогенолиз). В-третьих, при активации перечисленных метаболических путей гормонами, на фоне постоянного присутствия этанола в плазме крови даже в незначительных количествах, образуются агрессивные субстраты, которые депонируются в печени, миокарде, головном мозге и нарушают их функции.
Представленная цепь событий отражает суть возникающих нарушений только в общих чертах. Более глубокий анализ патохимических нарушений при хронической алкоголизации позволяет выделить их ключевые звенья, на которые могут быть направлены усилия фармакотерапии.
Первым метаболитом этанола является ацетоальдегид, который превосходит по токсичности исходную молекулу. Ацетоальдегид преимущественно образуется в гепатоцитах при участии алкоголь-дегидрогеназ (см. рис. 4).
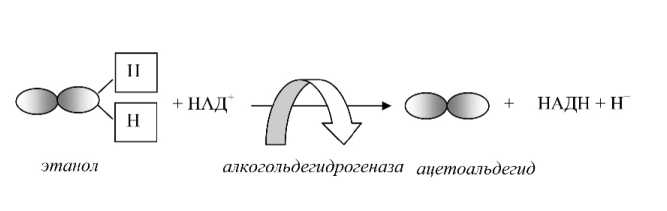
Рис. 4. Образование ацетоальдегида и дефицита НАД+
Условные обозначения:
НАД+ – никотинамиддинуклетотидфосфат;
НАДН – никотинамиддинуклетотидфосфат (восстановленная форма).
Второй протон при восстановлении НАД+ высвобождается в среду. Дефицит НАД+ и одновременное накопление ионов водорода создают условия для развития ацидоза.
Нужно сказать, что все дегидрогеназы переносят электроны и протоны, образующиеся в окислительно-восстановительных реакциях, поэтому они нуждаются в ко-ферментах, т. е. в промежуточных переносчиках функциональных групп. Наиболее важным из них является НАД+-амидникотиновой кислоты, который передает восстановительный эквивалент в дыхательную цепь и участвует в аккумуляции энергии в макроэргах. В результате образования ацетоальдегида НАД+ восстанавливается в НАДН + Н+3, таким образом в ходе реакции биодеградации этилового спирта НАД+ потребляется.
Далее из ацетоальдегида образуется уксусная кислота. Реакция ее образования также протекает с участием альдегиддегидрогеназ, что означает повторное потребление НАД+.
Следовательно, в результате двух метаболических реакций, которые претерпевает этанол в клетках печени, дважды снижается концентрация НАД+.
Дефицит НАД+ сопровождается: блокадой глюконеогенеза; замедлением гликолиза и цикла Кребса; остановкой бета-окисления и отложением жира в печени; изменением поляризации клеточных мембран различных органов за счет сдвига соотношения НАДН/ НАД+.
В результате этого углубляется гипогликемия и возникает дефицит энергии. Клиническими эквивалентами этих изменений являются: слабость, разбитость, «плохое самочувствие» в целом, чувство тяжести в области сердца, головная боль, озноб, гипергидроз, нарушение работы желудочно-кишечного тракта.
С целью компенсации уровня глюкозы плазмы крови распадается гликоген печени. Однако его запасы даже у здоровых людей невелики. Всего лишь на несколько часов гликогенолиз покрывает расход глюкозы нейронами мозга и эритроцитами крови (самыми энергоемкими потребителями), после чего его депо истощаются.
У голодных людей, у лиц, находящихся на диете, у больных диабетом, принимающих гипогликемические средства (за исключением толбутамида), у пациентов, принимающих гепатотоксичные препараты (парацетамол, изониазид, альдомет, фенотиазины и т. д.), бета-адреноблокаторы или средства для снижения массы тела, а также при повторном приеме алкоголя, – запасы гликогена в печени снижены, поэтому гипогликемия у них развивается стремительно, является тяжелой и длительной (Ионин М. Л., 1998). У алкоголиков запасы гликогена в печени снижены почти до нуля.
У здоровых, сытых и трезвых людей существует мощный механизм защиты от гипогликемии. Это синтез глюкозы de novo в печени и в почках. Он осуществляется из глюкогенных аминокислот, лактата и глицерина. Этот процесс называется глюконеогенезом, и его мощность составляет до 250 г глюкозы в сутки. Подчеркнем, что глюконеогенез является самым главным источником питания нейронов и эритроцитов, которые полностью зависят от постоянного интенсивного снабжения глюкозой. Однако для осуществления глюконеогенеза необходим НАД+, запасы которого у лиц, систематически употребляющих спиртное, истрачены на биотрансформацию этилового алкоголя. В этих условиях НАД+ отчуждается от других, порой «недублируемых», биохимических реакций (например, из реакций электронотранспортной цепи флавопротеинов), и они «останавливаются». Это усугубляет дефицит энергии и создает основу для гипоксии различных тканей.
Гликолиз должен осуществляться любой ценой, иначе клетки погибнут. Однако продолжающийся прием спиртного нарушает декарбоксилирование кетокислот и замыкает гликолиз на выходе. Тогда источником образования энергии становятся жиры (триацилглицериды). Они распадаются на жирные кислоты и глицерин. У человека жирные кислоты не могут трансформироваться в глюкозу, они поступают в кровь в неэстерифицированном состоянии (НЭЖК). Жирные кислоты – биохимически агрессивные субстраты – являются источником образования свободных радикалов, стимулируют высвобождение биологически активных веществ, поэтому существует путь их быстрой утилизации в печени, где они превращаются в ацетилкоэнзим-А. Концентрация последнего в печени резко увеличивается, его избыток конденсируется в ацето-уксусную кислоту, из которой образуются 3-гидроксибутират и ацетон, т. е. кетоновые тела. Возникают предпосылки для развития алкогольного кетоацидоза, опасного, рецидивирующего состояния, несвоевременное лечение которого может приводить к летальному исходу.
- Хроническая алкогольная интоксикация
- Дерматоглифика при идентификации личности
- Комментарий к нормативным правовым документам, регулирующим порядок определения степени тяжести вреда, причиненного здоровью человека
- Сочетание частных и публичных интересов при правовом регулировании медицинской деятельности
- Судебно-медицинская деятельность в уголовном судопроизводстве
- Теория и практика использования медицинских знаний в гражданском судопроизводстве России




