Основы биохимии. Учебно-тренировочные задания для студентов медицинских специальностей

000
ОтложитьЧитал
Предисловие к изданию
Науки о жизни (англ. life sciences) – крупный раздел и структурная единица естествознания, мультидисциплинарное комплексное направление основанное на изучении живых организмов и их природных связях, в котором ежегодно публикуются наиболее интересные открытия и исследования ученых всего мира. В 2014 году в России науки о жизни включены в список приоритетных направлений развития науки и технологий до 2030 года. Одним из важнейших направлений life sciences является биохимия.
Биохимия – одна из фундаментальных теоретических наук, которая изучает состав, структуру и свойства химических соединений, формирующих живые системы, а также их взаимодействие и взаимопревращение в процессе метаболизма. Это важнейшая наука, формирующая мировоззрение биологов и медиков. Это наука, изучение которой базируется на важнейших представлениях о химии, биологии, физике.
Представленная авторами книга, является продолжением серии учебно-методических пособий и учебников по биохимии, которые активно используются в учебно-методическом комплексе (УМК) при изучении данной дисциплины студентами-медиками в МИ РУДН.
Пособие «Основы биохимии. Учебно-тренировочные задания для медицинских специальностей» составлены сотрудниками кафедры биохимии им. академика Берёзова Т. Т. Российского университета дружбы народов и факультета биологии и биотехнологии (базовая кафедра ИБХ РАН) Национального исследовательского университета «Высшая школа экономики» в соответствии с ФГОС и рассчитано для использования в учебном процессе ВУЗа по направлениям подготовки 34.03.01 Сестринское дело (бакалавриат) и 31.05.03 Стоматология (специалитет).
Сборник включает разноплановый комплект учебно-методических материалов:
1. Основные теоретические сведения курса «Основы биохимии»
2. Основные термины и формулы биоорганических соединений и их метаболитов
3. Вопросы для самоконтроля
4. Контрольные работы с заданиями разной степени сложности (логические задания и задачи с развернутым решением)
5. Материалы к проведению коллоквиумов, включающие задания к рубежной аттестации с примеры тестов.
6. Итоговые задания для самостоятельной работы по вариантам.
Пособие адресовано студентам, аспирантам, стажерам и преподавателям для использования в учебном процессе при проведении аудиторных и дистанционных занятий по биохимии.
Коллектив авторов
Лобаева Татьяна Александровна – кандидат биологических наук, доцент по специальности «биохимия», доцент кафедры биохимии им. акад. Берёзова Т. Т. МИ РУДН, директор направления 06.06.01 Биологические науки (подготовка кадров высшей квалификации) в РУДН
Жданов Дмитрий Дмитриевич – доктор биологических наук, заведующий лабораторией медицинской биотехнологии ИБМХ им. В. Н. Ореховича, доцент по специальности «биохимия», доцент кафедры биохимии им. акад. Берёзова Т. Т. МИ РУДН
Рыскина Елена Анатольевна – доктор биологических наук, профессор факультета биологии и биотехнологии НИУ «Высшая школа экономики», старший научный сотрудник лаборатории микрофлюидных технологий для биомедицины отдела функционирования живых систем ИБХ РАН.
Требования к освоению дисциплины «Биохимия»:
В результате изучения дисциплины студенты должны знать:
• правила техники безопасности и работы в биохимических лабораториях с реактивами, приборами, животными;
• физико-химическую сущность процессов, происходящих в живом организме на молекулярном, клеточном, тканевом и органном уровнях;
• строение и химические свойства основных классов биологически важных органических соединений;
• основные метаболические пути превращения углеводов, липидов, аминокислот, пуриновых и пиримидиновых оснований, роль клеточных мембран и их транспортных систем в обмене веществ;
• строение и функции наиболее важных химических соединений (нуклеиновых кислот, природных белков, водорастворимых и жирорастворимых витаминов, гормонов и др.);
• физико-химические методы анализа в медицине (титриметрический, хроматографический, спектрофотометрический, фотоэлектроколориметрический);
• роль биогенных элементов и их соединений в живых организмах;
• основы химии гемоглобина, его участие в газообмене и поддержании кислотно-основного состояния;
• теоретические основы информатики в медицинских и биологических системах, использование информационных компьютерных систем.
В результате изучения дисциплины студенты должны уметь:
✓ пользоваться учебной, научной, научно-популярной литературой, сетью Интернет и учебным порталом для профессиональной деятельности;
✓ пользоваться физическим, химическим и биологическим оборудованием;
✓ производить расчёты по результатам эксперимента, проводить элементарную статистическую обработку экспериментальных данных;
✓ классифицировать химические соединения, основываясь на их структурных формулах;
✓ прогнозировать направление и результат физико-химических процессов и химических превращений биологически важных веществ;
✓ отличать в сыворотке крови нормальные значения уровней метаболитов (глюкозы, мочевины, билирубина, мочевой кислоты, молочной и пировиноградной кислот и др.) от патологически изменённых, читать протеинограмму и объяснять причины различий; трактовать данные энзимодиагностических исследований сыворотки крови.
По окончании курса «Биохимия» студенты должны владеть:
► химической и биохимической терминологией;
► базовыми технологиями поиска и преобразования информации, в том числе с использованием учебных образовательных ресурсов;
► понятием ограничения в достоверности и специфику наиболее часто встречающихся лабораторных тестов
Список сокращений и условных обозначений, принятых в биохимии
АДФ – аденозиндифосфат
АлАТ – аланинаминотрансфераза
АМК – аминокислота
АМФ – аденозинмонофосфат
цАМФ – циклический АМФ
АПБ – ацилпереносящий белок
АсАТ – аспартатаминотрансфераза
АТФ – аденозинтрифосфат
АТФаза – аденозинтрифосфатаза
ГАМК – гамма-аминомасляная кислота
ГАФ – глицеральдегид-3-фосфат
ГДФ – гуанозиндифосфат
ГМФ – гуанозинмонофосфат
ГМГ-КоА – β-гидрокси-β-метил-глутарил-КоА
цГМФ – циклический ГМФ
ГТФ – гуанозинтрифосфат
ДАГ – диацилглицеролы
ДАФ – диоксиацетонфосфат
ДНК – дезоксирибонуклеиновая кислота
ДНКаза – дезоксирибонуклеаза
ДНФГ- 2,4-динитрофенилгидразин
ДОФА – диоксифенилаланин
ИМФ – инозинмонофосфат
кат – катал
КоА – кофермент (коэнзим) А
КоQ – кофермент (коэнзим) Q
КФ – классификация ферментов
КФК – креатинфосфокиназа
ЛДГ – лактатдегидрогеназа
ЛП – липопротеины
ЛПВП – липопротеины высокой плотности
ЛПНП – липопротеины низкой плотности
ЛПОНП – липопротеины очень низкой плотности
МАГ – моноацилглицеролы
МАО – моноаминооксидаза
МДА – малоновый диальдегид
НАД+ – никотинамидадениндинуклеотид окисленный
НАДН(Н+) – никотинамидадениндинуклеотид восстановленный
НАДФ+ – никотинамидадениндинуклеотидфосфат окисленный
НАДФН(Н+) – никотинамидадениндинуклеотидфосфат восстановленный
ПВК – пировиноградная кислота
ПФ – пиридоксальфосфат
РНК – рибонуклеиновая кислота
т-РНК – транспортная РНК
РНКаза – рибонуклеаза
СДГ – сукцинатдегидрогеназа
ТАГ – триацилглицеролы
ТГФК – тетрагидрофолиевая кислота
ТДФ – тимидиндифосфат
ТМФ – тимидинмонофосфат
ТПФ – тиаминпирофосфат
ТТФ – тимидинтрифосфат
ТХУ – трихлоруксусная кислота
УДФ – уридиндифосфат
УМФ – уридинмонофосфат
УТФ – уридинтрифосфат
ФАД – флавинадениндинуклеотид окисленный
ФАДН2 – флавинадениндинуклеотид восстановленный
ФЕП – фосфоенолпируват
ФМН – флавинаденинмононуклеотид
Фн – неорганический фосфат
ФФн – неорганический пирофосфат
ФРПФ – 5-фосфорибозил-1-пирофосфат
ФФК – фосфофруктокиназа
ФЭК – фотоэлектроколориметр
ХЭ – холинэстераза
ЦДФ – цитидиндифосфат
ЦМФ – цитидинмонофосфат
ЦТК – цикл трикарбоновых кислот (цикл Кребса)
ЦТФ – цитидинтрифосфат
ЩУК – щавелевоуксусная кислота
ЭПС – эндоплазматическая сеть
D – оптическая плотность
Dоп – оптическая плотность опытного
образца
Dст – оптическая плотность стандартного образца
Dк – оптическая плотность контрольного образца
Dx – оптическая плотность исследуемого образца
КМ – константа Михаэлиса
Vmax – максимальная скорость реакции
SAM – S-аденозилметионин
Раздел I. Аминокислоты и простые белки. Ферменты. Витамины. Гормоны
1. Теоретический блок
1.1. Основные теоретические сведения и термины раздела
Биохимия – это фундаментальная наука, которая изучает состав, строение и свойства веществ, входящих в состав биологических систем, а также их превращения в процессе жизнедеятельности.
Главной задачей биохимии является установление связи между молекулярной структурой и биологической функцией химических компонентов организма.
Таблица 1

Аминокислоты
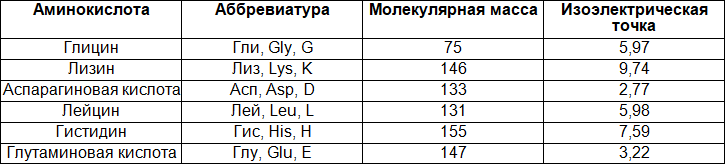
Аминокислоты – это органические карбоновые кислоты, у которых, один атом водорода замещен на аминогруппу. Таким образом, аминокислоты содержат карбоксильную группу (-СООН), аминогруппу (-NH2), асимметричный атом углерода и боковую цепь (радикал – R). Именно строением боковой цепи аминокислоты и отличаются друг от друга.

Рис. 1. Общий план строения аминокислот
Аминокислоты, кодируемые генетическим кодом и включающиеся в процессе трансляции в белки человека, называют протеиногенными. Таких аминокислот 20, часть из них может синтезироваться в организме человека (заменимые аминокислоты), а часть поступает с пищей (незаменимые аминокислоты).
В основу современной классификации аминокислот положено химическое строение их радикалов. Согласно это классификации протеиногенные аминокислоты делятся на 3 группы: гидрофобные, гидрофильные (незаряженные, отрицательно и положительно заряженные) и амфифильные.
Каждая аминокислота имеет не только своё название (тривиальное и химическое), но и принятое трехбуквенное сокращение, а также латинский однобуквенный символ: Ala Аланин (A), Leu Лейцин (L), Arg Аргинин (R), Lys Лизин (K), Asn Аспарагин (N), Met Метионин (M), Asp Аспарагиновая кислота (D), Phe Фенилаланин (F), Cys Цистеин (C), Pro Пролин (P), Gln Глутамин (Q), Ser Серин (S), Glu Глутамин. к-та (E), Thr Треонин (T), Gly Глицин (G), Trp Триптофан (W), His Гистидин (H), Tyr Тирозин (Y), Ile Изолейцин (I), Val Валин (V).
Таблица 2. Описание аминокислот
Следует отметить, что аминокислоты являются не только структурными элементами пептидов и белков, но и входят в состав других природных соединений (коферментов, конъюгированных желчных кислот, антибиотиков). Некоторые аминокислоты являются предшественниками биологически активных веществ (гормонов, биогенных аминов) или важнейшими метаболитами (глюконеогенез, биосинтез и деградация протеиногенных аминокислот, цикл мочевинообразования).
Таблица 3. Подходы к классификации аминокислот

Белки и пептиды
Пептиды – это органические соединения, построенные из остатков аминокислот, соединенных с помощью пептидной связи. Пептиды, последовательность которых короче 10–20 аминокислотных остатков, могут также называться олигопептидами, при большей длине последовательности они называются полипептидами.
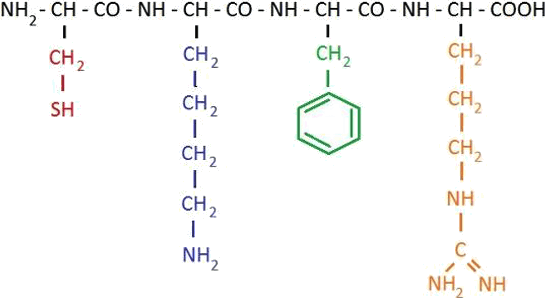
Рис. 2. Общий план строения пептида
Белками обычно называют полипептиды, содержащие 50 аминокислотных остатков и более.
Белки оставляют основу структурных элементов клеток и тканей, а также выполняют многообразные жизненно важные функции (транспортные, защитные, регуляторные, каталитические), обусловленные способностью за счет своей уникальной пространственной конфигурации распознавать другие молекулы и взаимодействовать с ними.
Полипептидная цепь состоит из остова (скелета), имеющего повторяющуюся последовательность и отдельных боковых цепей (радикалов). Последовательность аминокислот в цепи изображают, начиная с N-конца. Единственным отличием одних белков от других является сочетание радикалов, входящих в него.
Каждый белок характеризуется специфической аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией).
Таблица 4. Уровни структурной организации белков

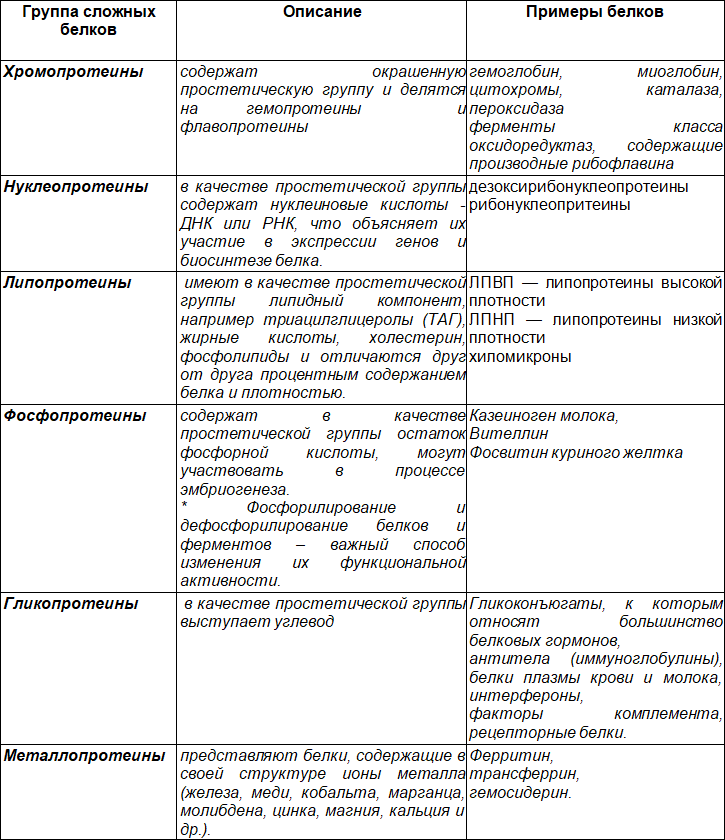
Белки условно подразделяют на простые (при гидролизе образуют смесь аминокислот) и сложные, или конъюгированные (состоят из белкового и небелкового компонентов). В качестве небелковой части (простетической группы) сложных белков могут выступать различные химические соединения, что находит отражение в классификации данной группы биологических соединений.
Таблица 5. Подходы к классификации сложных белков
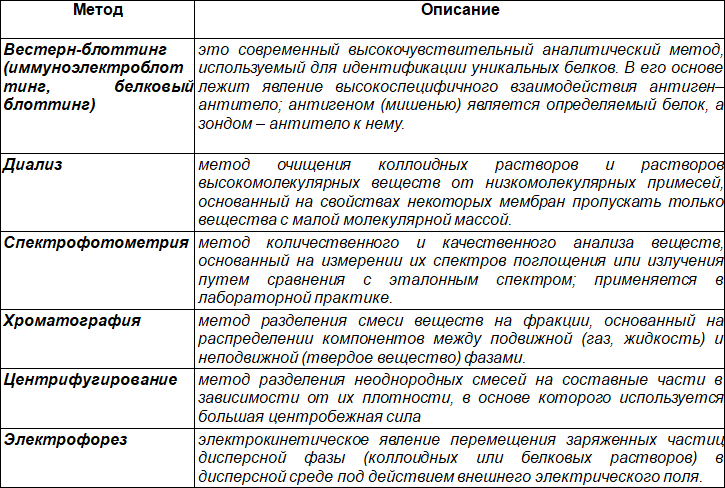
Большинство методов анализа белков и аминокислот связаны с физико-химическими свойствами последних, например, с наличием определенных функциональных групп, размером и формой молекул, подвижностью в электрическом поле, различным распределением в системе подвижной и неподвижной фазы при разных видах хроматографии, способностью к поглощению в ультрафиолетовой области спектра.
Таблица 6. Методы очистки и анализа белков и аминокислот
Основные термины раздела:
α-Аминокислоты – производные карбоновых (органических) кислот, у которых один из атомов водорода у α-углеродного атома замещен на аминогруппу; аминокислоты являются мономерами для биосинтеза пептидов и белков.
Белки – высокомолекулярные соединения, биополимеры, состоящие из остатков аминокислот, соединенных пептидными связями, имеющие определённую структурную и пространственную организацию и обладающие различными функциями.
Изоэлектрическая точка (ИЭТ, рI) – величина pH среды, при которой определённая молекула или её поверхность не несёт электрического заряда, то есть электронейтральна.
Полипептиды – биополимеры, содержащие от 10 до 50 аминокислотных остатков, связанных пептидными связями.
Посттрансляционная модификация – процесс образования функционально активных белков из синтезированных на рибосомах полипептидных цепей, включающий реакции ограниченного протеолиза, присоединения простетических групп, модификации аминокислотных радикалов (гидроксилирование, карбоксилирование, фосфорилирование, окисление и др.), образования дисульфидных связей, а также формирования третичной структуры и сборку субъединиц в олигомерные соединения.
Фолдинг – процесс формирования трехмерной пространственной структуры белка из вновь синтезированной полипептидной цепи при участии специфических белков-шаперонов.
Шапероны – группа белков, обеспечивающих правильную пространственную укладку полипептидной цепи в процессе посттрансляционной модификации, а также ренатурацию поврежденных белков и стабилизацию белков с неустойчивой конформацией.
Нуклеотиды и нуклеиновые кислоты
Нуклеиновые кислоты – это биополимеры, мономерами которых являются нуклеотиды. Любой нуклеотид в своей структуре имеет 3 фрагмента:
1) пуриновое или пиримидиновое азотистое основание;
2) остаток сахара-пентозы (рибозы или дезоксирибозы);
3) остаток фосфорной кислоты.
В зависимости от числа фосфатных групп различают нуклеозидмонофосфаты (например, АМФ, ГМФ), нуклеозиддифосфаты (УДФ, ЦДФ) и нуклеозидтрифосфаты (АТФ, УТФ); название нуклеотидов формируется в зависимости от азотистого основания и числа остатков фосфорной кислоты.
Нуклеиновые кислоты выполняют функцию хранения и передачи наследственной информации, а их структурные компоненты (нуклеотиды) входят в состав коферментов (НАД+, ФАД, КоА), являются макроэргическими соединениями (АТФ, УТФ, ЦТФ, ГТФ, ТТФ) и вторичными посредниками в передаче гормонального сигнала (цАМФ, цГМФ).
Гетероциклы, лежащие в основе структуры азотистых оснований:
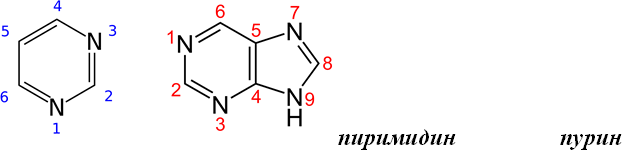
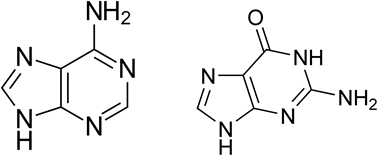
К пуриновым азотистым основаниям относят аденин (6-аминопурин) и гуанин (2-амино-6-гидроксипурин).
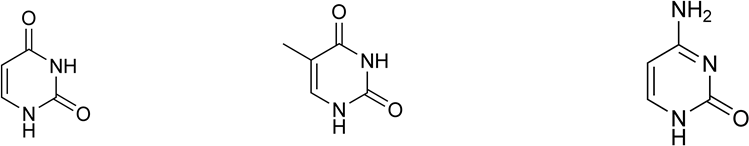
К пиримидиновым азотистым основаниям относят урацил (2,4-дигидроксипиримидин), тимин (5-метилурацил; 2,4-дигидрокси-5-метилпиримидин), цитозин (4-амино-2-гидроксипиримидин).
Различают также минорные азотистые основания, которые представляют собой видоизмененные азотистые основания, отличающиеся по строению от аденина, гуанина, урацила и тимина; к ним относятся 5-оксиметилцитозин, дигидроурацил, псевдоурацил, 1-метилурацил, оротовая кислота, N6-метиладенин, N-метилгуанин, и др.
Основные термины раздела:
Азотистые основания – общее название азотсодержащих гетероциклических органических соединений, входящих в состав нуклеозидов и нуклеотидов.
Нуклеозиды – органические природные соединения, состоящие из пиримидинового или пуринового основания, связанного N-гликозидной связью с остатком 2-дезоксирибозы или D-рибозы.
Нуклеотиды – природные или синтетические соединения, у которых гидроксильный остаток пентозы в составе нуклеозида этерифицирован одной или несколькими фосфатными группами
Нуклеиновые кислоты – природные высокомолекулярные биополимеры, мономерами которых являются мононуклеотиды, связанные 3,5 -фосфодиэфирной связью; в зависимости от структуры нуклеотидов различают рибо- (РНК) и дезоксирибонуклеиновую (ДНК) кислоту; нуклеиновые кислоты участвуют в хранении, передаче и реализации генетической информации.
Ферменты
Ферменты (от лат. fermentum «закваска»), или энзиимы – обычно сложные белковые соединения, РНК (рибозимы) или их комплексы, ускоряющие химические реакции в биологических системах. Ферменты являются биокатализаторами, т. е. ускоряют химические реакции в клетке.
Проферментами зимогенами называют неактивные предшественники ферментов, которые могут активироваться через избирательное расщепление белковой молекулы, реакции фосфорилирования или дефосфорилирования, диссоциации, а также агрегации протомеров и др.
Поскольку все ферменты являются белками, то обладают всеми физико-химическими свойствами белков. По структуре ферменты делятся на простые и сложные.
Простые ферменты состоят только из аминокислот – например, пепсин, трипсин, лизоцим. Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор (коэнзим, кофермент).
С химической точки зрения, кофермент – это низкомолекулярное органическое соединение, являющееся составной частью сложного белка, обладающего каталитической активностью; большинство коферментов являются производными водорастворимых витаминов, а также нуклеозидов, пептидов и др.

Рис. 3. Структура важнейших коферментов (НАД и ФАД)
Все ферменты, изученные к настоящему времени, включены в особый каталог (классификация ферментов – КФ) и имеют свой классификационный номер, в котором первая цифра указывает на принадлежность к одному из 7 классов ферментов:
1) оксидоредуктазы
2) трансферазы
3) гидролазы
4) лиазы
5) изомеразы
6) лигазы (синтетазы)
7) транслоказы
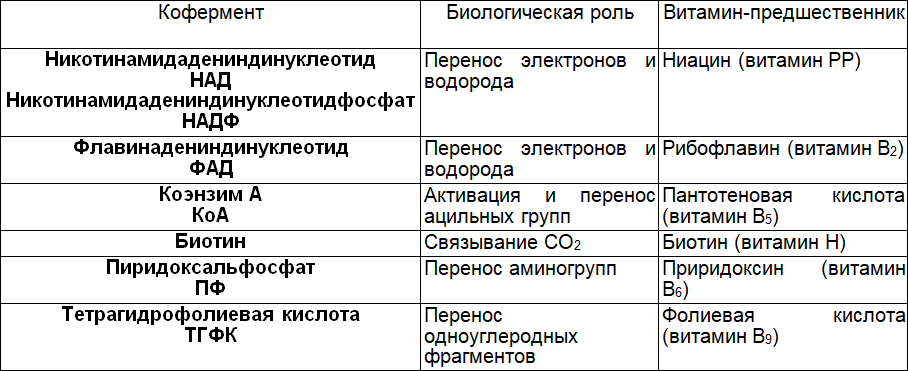
Таблица 7. Взаимосвязь витаминов и коферментов
Принципиальная структура фермента включает:
а) активный центр фермента – это уникальная комбинация аминокислотных остатков белковой молекулы, участвующих в присоединении и превращении субстрата, формируется на уровне третичной структуры. В активном центре выделяют субстратсвязывающий (якорный) участок и каталитический участок.
б) аллостерический центр – участок фермента, расположенный вне активного центра и присоединяющий низкомолекулярный аллостерический эффектор.
Примерами аллостерических эффекторов являются низкомолекулярные лиганды, вызывающие изменение активности фермента вследствие их связывания в аллостерическом центре (НАД+, НАДН, АТФ, АДФ и др.).
Изучение ферментов (энзимов) выделено в отдельную науку – энзимологию. Все ферменты имеют белковую природу, чем объясняются их свойства (термолабильность, зависимость активности от рН среды, высокоспецифичное действие по отношению к реагирущим веществам – субстратам ферментативной реакции).

Рис. 4. Пример ферментативной реакции с участием оксидоредуктазы
Важнейшей характеристикой ферментативной реакции является константа Михаэлиса (КM) – это величина, характеризующая сродство фермента к субстрату; численно равна концентрации субстрата, при которой скорость реакции составляет половину максимальной скорости (Vmax).
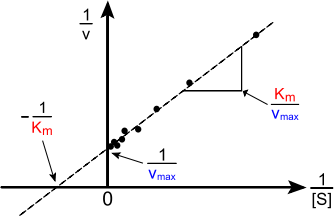
Рис. 5. Графическое изображение ферментативной реакции в обратных координатах
На активность фермента могут повлиять различные факторы. Существуют разные типы ингибирования ферментов.
Таблица 8. Типы ингибирования ферментов

Конкурентное ингибирование – подавление скорости ферментативной реакции веществами, структурно сходными с субстратом. В этом случае, ингибитор связывается с активным центром фермента и вытесняется из него при повышении количества вступающего в реакцию субстрата; ингибирование характеризуется увеличением константы Михаэлиса (КM) без изменения максимальной скорости реакции (Vmax).
Другой вариант – неконкурентное ингибирование – подавление скорости ферментативной реакции веществами, не имеющими структурного сходства с субстратом и связывающимися не с активным центром, а в аллостерическом центре. В данном случае, блокируется каталитическое превращение субстрата, поэтому снижается максимальная скорость реакции, а величина константы Михаэлиса (КМ) не меняется.
Активность ферментов выражается в каталах (количество фермента, которое превращает 1 моль субстрата за 1 с), а также в международных единицах (Е) (количество фермента, превращающего 1 мкмоль субстрата за 1 мин).
Помимо отдельных ферментов известны и мультиферментные комплексы: пируватдегидрогеназный комплекс (пируватдегидрогеназа, ПДК), превращающий пируват в ацетил-SКоА, α-кетоглутаратдегидрогеназный комплекс (в цикле трикарбоновых кислот) превращающий α-кетоглутарат в сукцинил-SКоА, комплекс под названием "синтаза жирных кислот" (или пальмитатсинтаза), синтезирующий пальмитиновую кислоту.
Основные термины раздела:
Ферменты (энзимы) – биологические катализаторы белковой природы с регулируемой активностью; молекула фермента может быть простым или сложным белком. В сложном белке (холофермент) присутствует небелковый компонент – кофермент.
Энзимодиагностика – диагностика заболеваний, основанная на определении изменения активности ферментов (изоферментов) в биологических жидкостях и тканях; например, для панкреатита характерно повышение в плазме крови активности альфа-амилазы, для инфаркта миокарда – активности креатинкиназы, трансаминаз и др.
Энзимология – раздел биохимии, изучающий строение, свойства и механизм действия ферментов.
Энзимопатия – общее название патологических состояний, развивающихся вследствие отсутствия или изменения активности каких-либо ферментов. Наследственные энзимопатии связаны с генетически обусловленной недостаточностью одного или нескольких ферментов (фенилкетонурия, гистидинемия, гликогенозы, галактоземия, липидозы, мукополисахаридозы).
Энзимотерапия – применение ферментов с лечебной целью. Например, при гнойно-некротических процессах, а также в качестве отхаркивающих средств используют протеолитические ферменты – трипсин, химотрипсин. Для улучшения процессов пищеварения используют препараты, содержащие ферменты желудочно-кишечного тракта (пепсин). Фибринолитические ферменты (стрептокиназа) используются для растворения тромбов. Гиалуронидазу применяют при контрактурах, для рассасывания гематом и рубцов (после травм, ожогов, операций).
