Предисловие
«Наука начинается с удивления», – сказал более двух тысяч лет назад древнегреческий философ Аристотель. Любопытство, способность удивляться непонятному, задавать множество вопросов свойственны детям. И задают они бесчисленные вопросы «что, как и почему» своим родителям. С возрастом эта способность удивляться обычно проходит. А может быть, подростки, а тем более взрослые, просто стесняются задавать разнообразные «глупые» вопросы. Да и кому их задавать, когда вокруг все заняты своими делами. Зачем задумываться над непонятным, когда кругом так много развлечений! Можно целый день смотреть телевизор и через час забыть о том, что показывали. Можно прочитать параграф в школьном (или вузовском) учебнике, ответить на уроке (или сдать зачет либо экзамен) и затем забыть о прочитанном – причем навсегда! К чему приводит такое отношение к окружающему нас миру? К распространению суеверий, например. Когда Нильса Бора спросили, неужели он верит тому, что прибитая над дверями его дома подкова приносит удачу, знаменитый физик ответил: «Конечно, не верю. Но, говорят, подкова приносит удачу даже тем, кто в это не верит». Бор, конечно, пошутил. Но сколько людей действительно верят знахарям и шаманам, верят бесчисленным рекламным объявлениям, обещающим излечение за пять минут от всех возможных и невозможных болезней, верят многим другим сказкам про инопланетян, «барабашек» и другую «современную» нечистую силу, которая пришла на смену лешему да Бабе-яге. А все потому, что с детства не выработан критический и «вопрошающий» взгляд на мир, не выработана привычка находить ответ (или хотя бы попытаться его найти) на возникающие вопросы, находить объяснение непонятному. Цель этой книжки – показать, что, даже не обладая специальными знаниями, можно правильно воспринимать явления, которые нас окружают, пытаться хотя бы в общих чертах узнать, как устроены различные машины и механизмы, почему происходят те или иные процессы, в том числе химические и физические. А главное – постараться самому понять, как устроен окружающий нас мир. Ведь это очень интересно!

Глава 1
Вещи и вещества

Нас окружает множество веществ – в основном это не чистые химические соединения (с таковыми мы встречаемся очень редко, примером могут служить поваренная соль и сахар), а смеси, сплавы, композиты. Еще чаще мы сталкиваемся с тысячами различных вещей – от детских игрушек до автомобилей. И при изготовлении всех этих вещей не обойтись без химии. В этой главе будет рассказано о некоторых малоизвестных применениях химических веществ, облегчающих нам жизнь или даже спасающих ее. Об этом – первый рассказ.
Азид в мешке
Известно, что скорость химической реакции пропорциональна концентрации реагентов: чем она выше, тем чаще сталкиваются молекулы и тем быстрее идет реакция. Аналогично частота дорожно-транспортных происшествий при прочих равных условиях пропорциональна концентрации автомобилей на дорогах, которая неуклонно увеличивается. Соответственно растет и число аварий. Самые опасные происходят при лобовом столкновении. Даже если скорость каждого автомобиля не превышает 60 км/ч, суммарная скорость получается такой, что почти не оставляет шансов для находящихся в автомобиле. Можно ли в таких случаях защитить водителя и пассажиров или хотя бы спасти их жизни (о судьбе автомобиля говорить в таких случаях не приходится)? Одно из самых простых и надежных изобретений – ремни безопасности, которые спасли множество жизней. Но если скорость машины при лобовом столкновении велика, не спасают и они – ремень задерживает туловище, а голова по инерции продолжает движение вперед, что приводит к повреждению, нередко смертельному, шейного отдела позвоночника. И тут на помощь автомобилистам пришла химия. В 80-х гг. ХХ века химики ведущих автомобильных корпораций разработали новый способ защиты автомобилистов – подушку безопасности.
Она изготовлена из прочного полиамидного волокна и в сложенном виде занимает так мало места, что ее можно упрятать в стойку рулевого колеса. В случае лобового столкновения мешок почти мгновенно надувается и мягко принимает на себя поступательное движение как корпуса, так и головы водителя, спасая тем самым ему жизнь. И если к концу 80-х годов лишь один из 15 выпускавшихся в США автомобилей снабжался подушкой безопасности, то к 1995 г. их доля превысила 70 %, а еще через несколько лет ими снабжались практически все автомобили, причем каждый имел по два таких устройства – для водителя и для пассажира. Появились также подушки, расположенные сбоку, причем и для пассажиров, сидящих на заднем сиденье. Как же работает такая подушка? Поскольку счет при аварии идет на тысячные доли секунды (при скорости 108 км/ч машина проходит 10 см всего за 3 миллисекунды), никакие механические компрессоры или баллоны с сжатым газом не успеют надуть мешок за нужное время. Остается лишь одна возможность – взрывное разложение химического соединения с выделением большого объема газа. Химикам нужно было найти такое соединение, а остальное было уже делом техники. Вариантов оказалось немного. Остановились на распаде азида натрия – соли очень взрывчатой и очень ядовитой азотистоводородной кислоты HN3. Хотя эта кислота слабая (как уксусная), ее водные растворы обладают настолько сильным окислительным действием, что смесь HN3 и HCl растворяет золото и даже платину. Азиды тяжелых металлов (меди, серебра, ртути, свинца и др.) – весьма неустойчивые кристаллические соединения, которые взрываются при трении, ударе, нагревании, действии света. Взрыв может произойти даже под слоем воды! Азид свинца Pb(N3)2 используется как инициирующее взрывчатое вещество, с помощью которого подрывают основную массу взрывчатки. Для этого достаточно всего двух десятков миллиграммов этого вещества. Это соединение более взрывчато, чем нитроглицерин, а скорость распространения взрывной волны (детонации) при взрыве в 10 раз больше, чем у тротила, и достигает 45 км/с! Азид натрия, к счастью, не взрывается, хотя тоже сильно ядовит (его сильно разбавленные водные растворы иногда используют в качестве консерванта биохимических препаратов). При нагревании до 300 °С он очень быстро разлагается с выделением азота и мельчайших частиц натрия: 2NaN3 → 2Na + 3N2. Из 65 г (1 моль) NaN3 получается при обычных условиях около 35 л азота. Чтобы увеличить выход газа, а также связать очень реакционноспособный и легко загорающийся натрий, в смесь добавляют нитрат калия, который реагирует со свободным натрием: 10Na + 2KNO3 → K2O + 5Na2O + N2. Кстати, реакция азида щелочного металла с его нитратом давно использовалась химиками для синтеза чистого оксида натрия или калия (которые невозможно получить окислением металлов в кислороде или на воздухе), например: 5NaN3 + NaNO3 → 3Na2O + 8N2. Оксиды натрия и калия – тоже не подарок; для их связывания в исходную смесь вводят еще один компонент – мелкораздробленный диоксид кремния. В условиях реакции он связывает оксиды натрия и калия с образованием негорючих и безопасных силикатов: Na2O + SiO2 → Na2SiO3. Работает вся система так. В случае столкновения чувствительные датчики, установленные в автомобиле, передают сигнал на микропроцессор, который мгновенно оценивает ситуацию; если скорость автомобиля при ударе превышает определенное значение (обычно 35 км/ч), микропроцессор включает электрический запал, который запускает реакцию разложения азида. В результате перед человеком примерно за 0,04 секунды надувается мешок, содержащий около 70 литров азота, который спасет ему жизнь даже в таких случаях, которые раньше считались безнадежными. В автомобилях последних моделей возможно даже регулирование скорости наполнения мешка азотом в зависимости от массы водителя и его точного расположения в автомобиле.

На этот раз подушка безопасности защитила манекен
Однако не все так просто. Подушки безопасности, хотя и доказали свою эффективность, создают новые экологические проблемы. Ведь большинство автомобилей заканчивает свой век, ни разу не испытав серьезного столкновения. Поэтому на свалках вместо сравнительно безопасных груд ржавеющего металла могут образоваться очаги отравляющих веществ. Один из способов борьбы с этим – использование в подушках безопасности вместо порошка таблеток, которые можно было бы при необходимости извлекать и утилизировать. Другой путь – поиск менее опасных химических соединений, которые могли бы заменить азид натрия. Говоря об азиде натрия, нельзя не вспомнить еще одну историю, связанную с этим веществом. Как отмечалось, его разбавленные водные растворы обладают бактерицидным действием и могут служить консервантом биохимических препаратов. И вот в начале 70-х годов ХХ в. в некоторых американских и английских клиниках наблюдались странные явления. Время от времени из сливной раковины раздавались звуки, напоминающие пистолетные выстрелы, а в одном случае неожиданно взорвалась сливная трубка. К счастью, никто при этом не пострадал. Расследование показало, что виновником всех взрывов был очень слабый (0,01 %) раствор азида натрия, который использовали в качестве консерванта физиологических растворов. Излишки раствора азида в течение многих месяцев, а то и лет сливали в раковину – иногда до двух литров в день. Оказалось, во всех упомянутых случаях сливные трубки под раковинами были изготовлены из меди или латуни (такие трубки очень прочные, легко гнутся, особенно после предварительного прокаливания, поэтому их удобно устанавливать в сливной системе). Выливаемый в раковину раствор азида натрия, протекая по таким трубкам, постепенно реагировал с их поверхностью, образуя азид меди, а это вещество уже способно взрываться. Пришлось менять медные трубки на пластмассовые. Когда в одной из клиник проводили такую замену, оказалось, что снятые медные трубки сильно забиты твердым веществом. Специалисты, которые проводили «разминирование» сливной системы, чтобы не рисковать, подорвали эти трубки на месте, поместив их в металлический бак массой 1 т. Взрыв был настолько силен, что сдвинул бак с места на несколько сантиметров! Медиков не очень интересовала сущность химических реакций, приводящих к образованию взрывчатки. Можно предположить, исходя из сильных окислительных свойств азотистоводородной кислоты, что имела место такая реакция: анион N3–, окисляя медь, восстановился и образовал одну молекулу N2 и атом азота, который вошёл в состав аммиака. Остальная часть азид-анионов соединилась с катионами меди. Это соответствует уравнению реакции 3NaN3 + Cu + 3H2O → Cu(N3)2 + 3NaOH + N2 + NH3. С опасностью образования «бомбы в раковине» приходится считаться всем имеющим дело с растворимыми азидами металлов, в том числе и химикам, поскольку азиды используются для получения особо чистого азота, в органических синтезах, в качестве порообразователя – вспенивающего агента для получения газонаполненных материалов: пенопластов, пористой резины и т. п. Во всех подобных случаях надо проследить, чтобы растворы азида не соприкасались с тяжелыми металлами, а сливные трубки были пластмассовыми.
Пигменты и красители
По определению, пигменты (от лат. pigmentum – «краска») – это тонкоизмельченные порошкообразные красящие вещества, которые, в отличие от красителей, не растворяются ни в воде, ни в органических растворителях. Пигменты бывают природные (как правило, неорганические) и синтетические. Первым пигментом, который использовал человек, была сажа. Сажа в большем или меньшем количестве появляется везде, где горит огонь, поэтому неудивительно, что сажу начали использовать в декоративных целях примерно 20 тысяч лет назад, вскоре после изобретения способов добывать огонь. Сажу и теперь производят в огромных количествах и используют как наполнитель резины, пластмассы, для изготовления типографских красок. Сажа исключительно устойчива к внешним воздействиям; до сих пор сохранились рисунки человека каменного века, выполненные сажей на стенах пещер. Вероятно, самая знаменитая из них – пещера Ласко во Франции. Ее случайно обнаружили в 1940 г. мальчики под упавшим после бури деревом. На стенах пещеры с помощью сажи, а также красновато-коричневых природных пигментов изображено множество животных: быки, лошади, олени, бараны, медведи, зубры. Теперь в этой пещере – прекрасно оборудованный музей.

Рисунки древнего человека, выполненные природными пигментами
Самыми труднодоступными в течение многих тысячелетий были пигменты синего цвета. Вероятно, первое использование синей природной краски произошло примерно 5 тысяч лет назад. Во время раскопок шумерского города Ура Халдейского были найдены золотые и серебряные фигурки животных, украшенные ляпис-лазурью – полудрагоценным камнем, содержащим пигмент ультрамарин. Сравнительно недавно было показано, что синий цвет этого пигмента связан с присутствием в нем анион-радикала [·S3]–, в котором имеется неспаренный электрон (он изображен точкой). В Европе синие пигменты были настолько дорогими (их продавали буквально на вес золота), что порой специальные комиссии решали, какие именно участки росписи должны быть синего цвета. В античные времена использовали пигмент египетский синий, это был алюмосиликат меди (медное стекло). С VI–VII веков художники начали использовать природный ультрамарин, который готовили из ляпис-лазури, привозимой из Афганистана. По составу ляпис-лазурь – сложная смесь нескольких минералов, синий цвет которой придает гаюин – алюмосиликат, содержащий хлор и серу. Из килограмма лазури получали после длительной обработки всего 30 г синего пигмента. И лишь в 1704 г. был получен первый искусственный синий пигмент. Это была берлинская лазурь – гексацианоферрат железа-калия, содержащий атомы железа в разных степенях окисления: KFe+3[Fe+2(CN)6]. Синий кобальтовый пигмент – Тенарову синь (алюминат кобальта CoAl2O4) впервые получили во Франции в 1802 г., и был он в те времена очень дорогим. Однако известные к началу XIX века искусственные синие пигменты по своим качествам не могли заменить природную лазурь. В 1824 г. во Франции была обещана огромная премия в 6000 франков за способ получения искусственной лазури. Уже через четыре года премию получил Ж. Гиме; почти одновременно и независимо от него то же открытие сделал известный немецкий химик Л. Гмелин. Для получения искусственного ультрамарина прокаливали белую глину (каолин) с сульфатом калия и с углем. С тех пор природный камень перестали переводить на краску. Органический синий пигмент – индиго начали добывать еще несколько тысячелетий назад в Индии. Индиго добывали из листьев различных растений. Наибольший выход получался из растения рода Indigofera, которое произрастает в странах с тропическим влажным климатом. В Европе до середины XVII века, когда голландцы начали ввозить индиго из южных колоний, этот краситель добывали из листьев местного растения – так называемой красильной вайды. Листья замачивали водой, при этом в раствор переходил бесцветный гликозид (соединение с глюкозой) индикан. Затем водный экстракт сбраживался под действием микроорганизмов. В результате ферментативного процесса образуется глюкоза и 3-гидроксииндол (индоксил) – бесцветное соединение, которое при окислении кислородом воздуха (быстрее на прямом солнечном свету) превращается в индиго, оседающее на дно сосуда в виде синих хлопьев. Вся цепочка превращений показана на схеме.
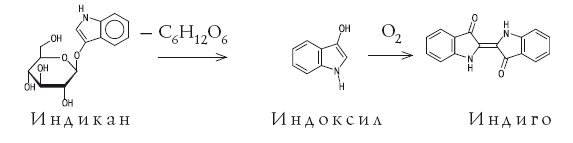
В начале XIX века Наполеон обратился к французским ученым с предложением найти способ получения индиго из отечественного сырья и предложил за решение этой задачи баснословную по тем временам сумму – 1 млн франков. Но в те времена химики еще не были готовы взяться за эту проблему: органическая химия находилась в зачаточном состоянии. Химическое строение индиго было установлено в 1883 г. немецким химиком Адольфом фон Байером – через 18 лет после того, как он начал исследовать этот краситель и спустя 5000 лет после его открытия человеком. Как заявил Байер, он может доказать экспериментально место каждого атома в молекуле индиго! Байеру удалось также синтезировать индиго, исходя из фенилуксусной кислоты С6Н5СН2СООН, однако этот синтез не нашел практического применения. Промышленный синтез индиго начался спустя несколько лет на баденской анилино-содовой фабрике (БАСФ), которая использовала метод, разработанный Карлом Хейманом. К началу ХХ века индиго синтезировали уже тысячами тонн, что соответствует сотням тысяч гектаров индиговых плантаций. Производству индиго сильно способствовало правительственное распоряжение, по которому синее сукно германской армии обязательно красилось синтетическим индиго. Выпуск индиго достиг максимума к концу 70-х гг. ХХ века – около 20 000 тонн в год. В конце XIX века БАСФ на разработку промышленного экономически выгодного синтеза индиго затратила 3 млн марок. А фирма «Людвигсхафен» ассигновала на исследования сумму, намного превосходившую стоимость самой фирмы! Этот рекорд, вероятно, никогда не будет превзойден. Потраченные деньги вернулись сторицей. Достаточно вспомнить гималаи джинсов, выпущенных за прошедшие годы и окрашенных синтетическим индиго.
А какой был первый синтетический краситель, для которого не существует природных аналогов? В книгах по истории химии пишут, что это был мовеин. В 1856 г. английский химик Уильям Генри Перкин, которому было тогда всего 18 лет, окисляя дихроматом калия неочищенный анилин (он содержал толуидины – метилпроизводные анилина), получил вещество красивого фиолетового цвета, пригодное для окрашивания тканей. Он назвал его мовеином (от англ. mauve – «мальва», травянистое растение с крупными яркими цветами). Перкин работал в домашней лаборатории, и его цель была совершенно иной – он надеялся получить из каменноугольного дегтя хинин – средство от малярии. Вместо лекарства он получил краситель, в результате чего бросил учебу и на деньги своей семьи построил фабрику, работа которой сделала ее хозяина очень богатым человеком.
Мовеин (смесь красителей)
Следует, однако, сказать, что честь открытия первого синтетического красителя из продуктов перегонки каменного угля принадлежит польскому химику Якубу Натансону. Работая в Тарту (в то время – Дерпт, а после 1893 г. – Юрьев) он почти одновременно с Перкином, но все же чуть раньше, получил нагреванием смеси анилина и дихлорэтана в запаянной трубке вещество кроваво-красного цвета, способное окрашивать ткани. Это был краситель фуксин. Последующие исследования показали, что Натансон получил, вероятно, смесь парарозанилина с его моно– и диметилзамещенными. Сейчас фуксин применяют в основном для окрашивания нетекстильных материалов – бумаги, кожи, дерева; для приготовления чернил, цветных карандашей, типографских красок.
Паранитрозанилин
В заключение – сведения о красителях, которые к концу ХХ века производились в наибольшем количестве. Первые два места делят индиго (его используют для окраски тканей) и так называемый дисперсный синий 79 (им красят полиэфирные волокна) – по 15 000 тонн в год. За ними следуют сернистый черный 1 (краситель для хлопка) – 10 000 т/год, активный черный 5 (краситель для хлопка) – 8000 т/год и кислотный черный 194 (краситель для полиамидных волокон, шерсти и кожи) – 7000 т/год.
Магнитом – по опилкам
Казалось бы, все, что касается игрушек для маленьких детей, уже изобретено и ничего принципиально нового создать невозможно. Однако это не так. Возьмем, например, игры, развивающие способность писать, а также создавать простые рисунки. Техническое задание таково: рисунок должен быть четким, легко стираться, а сама игрушка должна быть безопасной, причем – что немаловажно – безопасной именно для детей. В продаже можно встретить такую конструкцию. В герметичной коробке под пластмассовым прозрачным экраном помещен тонкий алюминиевый порошок (алюминиевая пудра). При встряхивании экран электризуется, и на него налипает слой порошка. С помощью помещенного в коробку штифта и двухкоординатного механизма, управляемого двумя ручками, можно нарисовать довольно сложные фигуры, «процарапывая» слой алюминия, то есть удаляя порошок острием штифта. Встряхивание коробки приводит игрушку в исходное состояние. К ее очевидным недостаткам относится невозможность оторвать штифт от экрана, то есть прервать линию (поэтому буквы и цифры нарисовать практически нельзя), а также сложность создания кривых: каждая ручка по отдельности позволяет проводить линию либо вправо-влево, либо вверх-вниз. Правда, последнее обстоятельство в какой-то мере может служить и достоинством игрушки, которая хорошо развивает координацию движения. Другой вариант подобной «рисовалки» еще проще. твердый темный лист покрыт гибкой матовой полимерной пленкой. Если с помощью заостренной палочки – стила – провести на пленке черту, то она прилипнет к подложке, и черта станет видна – останется темный след. Так можно нарисовать на пленке все, что угодно. Если же с помощью тонкого стержня, расположенного между пленкой и подложкой, отделить их друг от друга, все изображения исчезнут, и можно начинать с начала.

Игрушка
И вот новая остроумная игрушка (см. рисунок). Под прозрачным экраном – светло-серый порошок, сбоку в специальном углублении – «карандаш». Если его тонким металлическим кончиком провести по экрану, слегка его касаясь, под ним останется черный след. Передвинув расположенную снизу рукоятку из одного крайнего положения в Игрушка другое, можно стереть написанное или нарисованное и вернуть игрушку в исходное положение. Как же она устроена? Даже не ломая изделие, легко установить, что в его основе – магнитное действие: внутри – тонкий железный порошок, а наконечник «карандаша» – магнитик. В исходном положении более тяжелый железный порошок «тонет», и его не видно под слоем чего-то белого. Когда же магнитик подносят к экрану, он вытягивает железные опилки на поверхность, и они оставляют темный след. Длительное сохранение рисунка доказывает, что железному порошку непросто снова «утонуть» в вязкой массе. Нижняя ручка прикреплена к намагниченному стержню, расположенному за экраном. Проводя этим магнитом вдоль экрана, мы перемещаем все опилки к задней стенке, так что передняя светлеет. Это же можно сделать иначе, просто сильно встряхнув коробку, когда она находится в горизонтальном положении: более тяжелые железные опилки осядут вниз. (Если при этом коробку перевернуть, то опилки осядут на лицевую сторону, так что почернеет эта рабочая сторона.) Если вскрыть герметичный экран, обнаружится вот что. Верхняя и нижняя (она тоже прозрачная) поверхности разделены очень тонкими пластмассовыми перегородками, образующими сетку с ячейками около 1 мм (ее можно заметить на фотографии). Эта сетка разделяет рабочее поле на множество мелких ячеек, и в каждой ячейке перемещается своя небольшая порция магнитного порошка. Попасть из одной ячейки в другую он не может. Порошок смешан вовсе не с мелом или чем-то подобным, как могло показаться вначале; на самом деле он плавает в густой белой жидкости. Жидкость эта негорючая и испаряется очень медленно. Следовательно, это не органический растворитель, а скорее всего, вода. После ее испарения остается немного органического вещества, которое можно сжечь, и негорючий белый порошок, похожий на мел. Но мел можно исключить, потому что белый порошок не растворяется в соляной кислоте. Возможный вариант – диоксид титана, TiO2 – белый пигмент, который широко используется для изготовления белил. Что же представляет собой эта густая жидкость? Вероятный ответ таков. Один из способов промышленного производства поливинилхлорида – эмульсионная полимеризация. По этому способу инициатор радикальной полимеризации (например, перекись водорода) растворен в водной фазе, а полимеризация органического мономера идет в мицеллах – крошечных капельках, образованных эмульгатором – каким-либо поверхностно-активным веществом наподобие мыла. В результате получается латекс с размерами частиц полимера 0,03–0,5 мкм. Латекс сушат в распыленном виде, получая мелкий порошок полимера. Добавляя к нему растворитель, изготавливают пасты, вязкие коллоидные растворы. Такие растворы, которые называются пластизолем, можно перерабатывать в самые разнообразные изделия. Методом макания из пластизоля можно получить перчатки, которыми пользуются электрики (поливинилхлорид – прекрасный изолятор), изоляционный слой на ручках инструментов, покрытия на стеклянных флаконах с аэрозольной упаковкой медикаментов (например, ингалипта). Заливкой пластизоля в формы изготовляют воздушные и масляные фильтры для автомобилей, обувь, уплотнительные прокладки для крышек банок и бутылок, используемых для пищевых продуктов. Напылением пластизоля можно получить защитное покрытие для днищ и сварных швов автомобилей. А искусственную кожу или моющиеся обои можно получить методом шпредирования. Что означает это странное слово? По-английски to spread – «распределять по поверхности», «промазывать», в том числе и резиной. Но написание термина показывает, что он пришел в русский язык из немецкого, в котором сочетание sp чаще всего читается как «шп» (кстати, по-немецки Spreadingmaschine – «машина для прорезинивания тканей»). Наконец, из пластизоля можно делать мячи, детские игрушки и т. п. В пластизоль часто вводят значительные количества (до 50 % по массе) минеральных наполнителей – мел, каолин, аэросил (мелкодисперсный диоксид кремния SiO2), бентонит, диоксид титана и др. Значит, для изготовления нашей игрушки можно было использовать производимый промышленностью, а потому сравнительно недорогой поливинилхлоридный пластизоль. Остается восхититься изобретательностью тех, кто эту игрушку придумал.




